行业正在发生一场,生物治疗药物是目前增长最快的医药行业细分市场,2017年全球药物销售额排名前十的药品中,生物治疗药物占据七席。从早期研发、表征分析、工艺优化到CMC、QC 分析,生物制品在每一个环节均存在着极其复杂的不确定性。正因如此,2020 药典从编制之初,就强调要进一步完善生物制品全过程质量控制的要求,进一步补充完善生物检测技术、方法以及相关技术指南,并与国际接轨。
在药物开发和生产的所有阶段都必须进行生物药充分表征。在药物开发过程中,液相色谱-质谱(LC-MS)用于通过细胞系产生的单克隆抗体(mAbs)的结构表征,其主要目标是确证抗体分子结构,保证药物安全、有效,同时筛选目标单克隆细胞群。在整个生产过程中,需要持续监测制剂中抗体药物结构和成分,以评估批次放行所要求的纯度和异质性。
与小分子药物相比,更易在生产、运输和储存的过程中,发生各种翻译后修饰的变化,影响药物分子的稳定性,同时影响蛋白的结构和功能。
在合成和储存的过程中,容易形成结构相关杂质,许多结构相关杂质不但没有药物疗效,反而具有一定的毒副作用。欧盟药典规定需对含量在0.5%以上的相关结构杂质进行定性分析,对含量在1%以上的结构相关杂质进行定量分析并考察其毒副作用,美国药典也有类似规定,因此在多肽药物开发阶段控制杂质的性质及含量至关重要。
在生产过程中,宿主细胞残留在终产品中的其他蛋白质 (宿主细胞残留蛋白HCPs) 的存在会影响药物的安全性和有效性,如引起机体免疫反应,作为佐剂以增强对药物产品的免疫应答,以及具有蛋白水解活性的HCPs影响药物产品的稳定性,因此生物医药公司不断优化其纯化工艺,从而控制终产品中HCPs的种类和含量。在生物治疗药物开发过程中,明确分子的
及其对结构-功能和长期稳定性的影响对于确保产品品质、安全和有效来说至关重要。目前,通常采用色谱和电泳技术表征和监测各个PQA,支持批次放行、时间稳定性检测和工艺/配方开发。一些常规方法不仅占用大量时间和资源,且通常仅可用于间接衡量生物学相关PQA。基于液相色谱-质谱(LC-MS)肽谱分析和自动化原理的多属性方法(Multi-Attribute Method, MAM)可同时进行位点特异性的PQA检测、鉴定、定量和监测。与无法提供各个PQA位点特异性信息的传统分析手段相比,MAM可对PQA直接进行定量分析,丰富了对工艺和产品的认识。
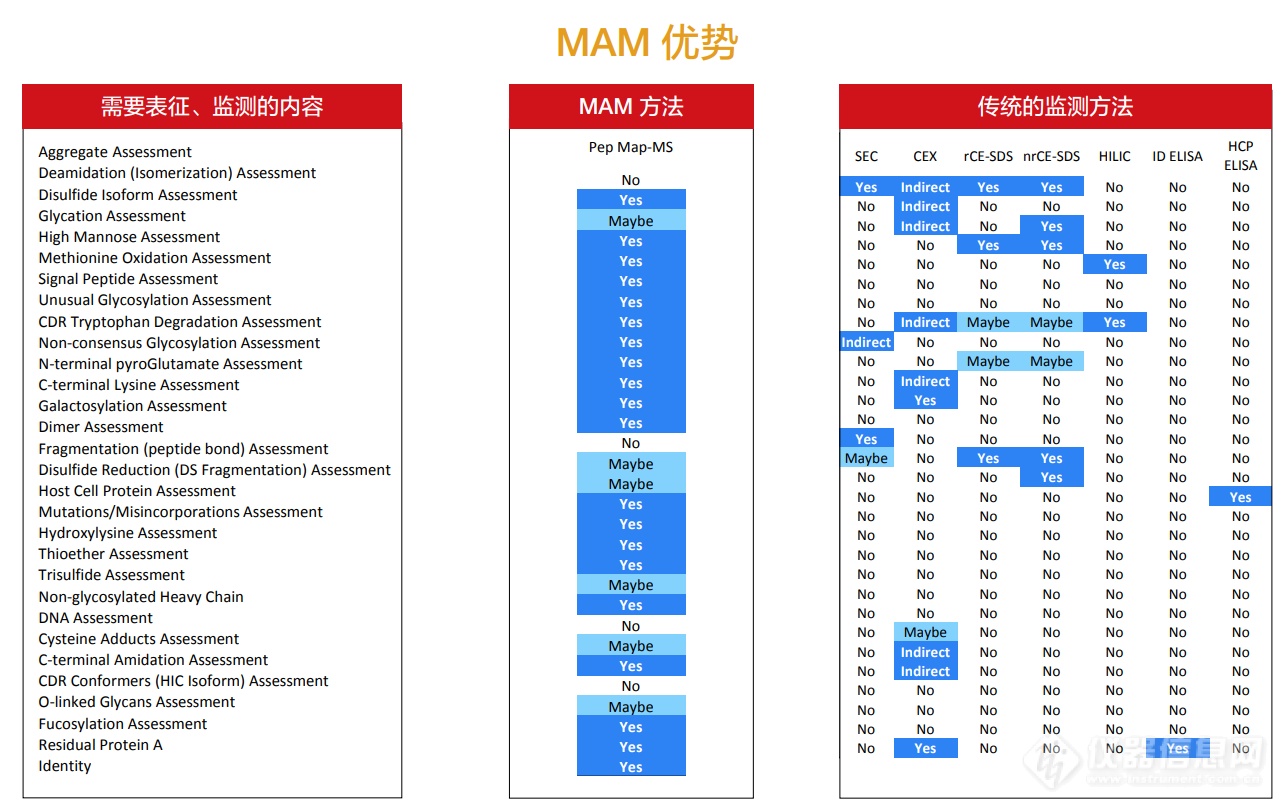
(HR Multi-Attribute Method,HR MAM)是一种功能强大的高分辨率高质量精度工作流程,可实现从研发直至质量控制(QC)阶段产品质量属性的全面表征和监控。众所周知,生物制药开发和制造的最终目标是以最低的成本,在尽可能短的时间内提供最高质量的产品。随着全新高分辨高质量精度HR MAM流程的发布,生物制药行业科学家现在能够将其取代治疗蛋白质表征和质量控制中许多耗时的分析方法。
NIBRT)是为生物工艺行业提供培训和研究解决方案的世界级研究所,位于都柏林附近。2016 年,NIBRT 与 Thermo Fisher Scientific建立了合作伙伴关系。近几年,生物治疗领域的头部企业已广泛接纳MAM,并且开始投入建设MAM工作流程已保障他们的产品质量,但实际操作起来却很困难,究其原因是在于缺乏一套完整的商业MAM解决方案。研究人员需要把多个硬件和软件模块组合在一起,对操作人员的专业技能要求极高,需要懂质谱的人来进行,这对于企业QC岗位来说是一个不小的挑战。
这次仪器信息网与赛默飞合办“生物药质量属性监测(MAM)会议”,为您解读国际成熟的生物药质量控制方法,并通过赛默飞强大、成熟、方便的MAM系统操作流程,为您的药物生产提供端到端的解决方案。此次会议,您将收获MAM应用,赛默飞Orbitrap Exploris MX新品应用,以及赛默飞与国际知名药企、药物研发机构的MAM应用策略。